Soie d’araignée rouge fluo : révolution scientifique ou coup de com’ ?
Quand CRISPR tisse sa toile : promesse de biomatériaux programmables ou simple effet de manche ?

Des chercheurs viennent de créer la toute première araignée génétiquement éditée par CRISPR capable de tisser une soie rouge fluorescente. Présentée comme une avancée majeure – presque un scénario de science-fiction – cette prouesse soulève autant d’enthousiasme que de questions. Est-ce vraiment un tournant dans la quête de super-matériaux inspirés de la nature, ou simplement un résultat spectaculaire taillé pour les communiqués de presse ? Avant de s’enflammer, il faut détricoter l’innovation réelle, la replacer dans l’histoire des soies transgéniques (des vers à soie phosphorescents aux fameuses « chèvres-araignées »), évaluer ses limites techniques, sa viabilité industrielle, et envisager les implications d’élever de telles chimères arachnéennes.
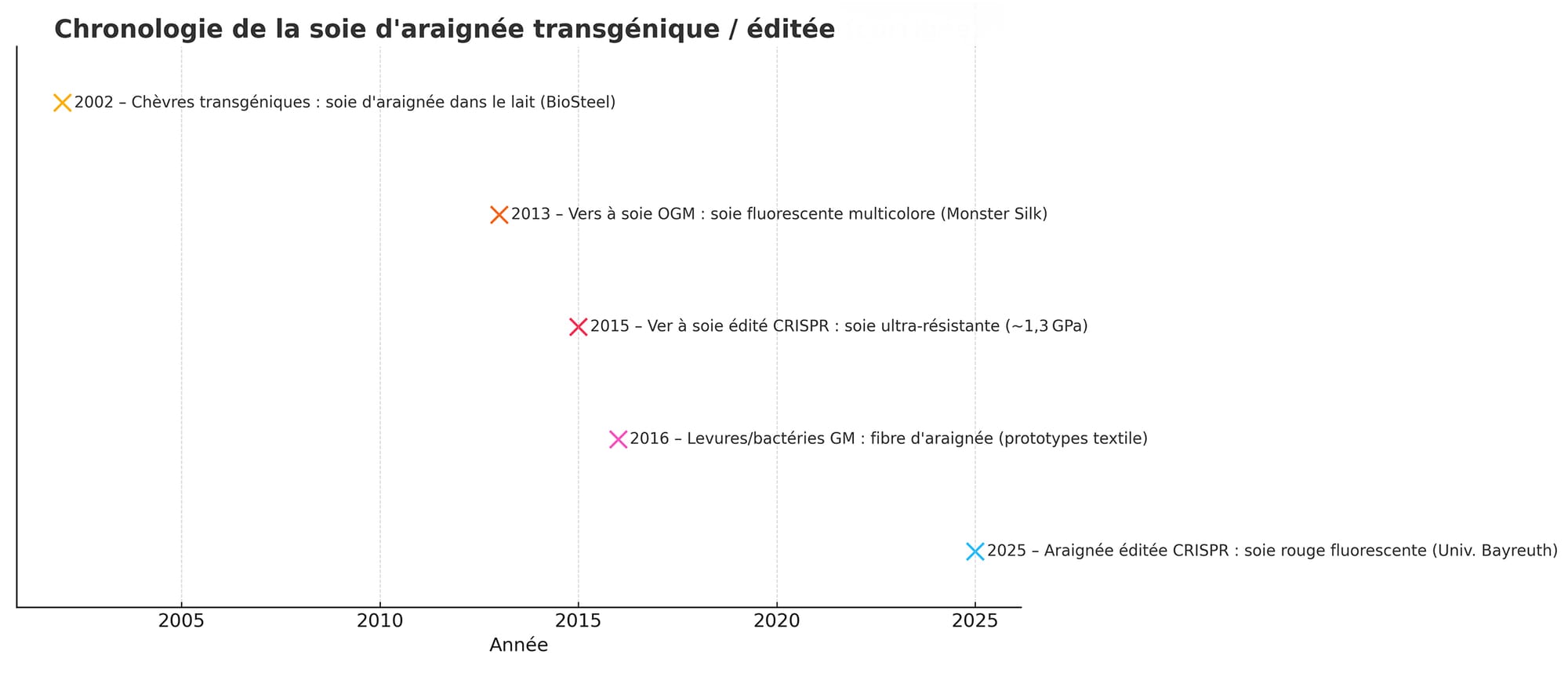
L’équipe de l’Université de Bayreuth en Allemagne a réussi un bel exploit : éditer le génome d’une araignée pour qu’elle incorpore un gène de protéine fluorescente rouge dans sa soie. Concrètement, ils ont anesthésié des femelles de l’araignée de maison Parasteatoda tepidariorum, injecté dans leurs ovaires un cocktail à base de CRISPR-Cas9 et d’ADN codant une protéine rouge fluorescente, puis les ont fait s’accoupler. Résultat : une partie de leurs bébés ont filé des fibres de soie rougeoyantes sous lumière UV, preuve que la modification génétique avait été transmise et exprimée sans perturber le mécanisme naturel du fil.
« Nous démontrons pour la première fois qu’il est possible d’incorporer une séquence génétique désirée dans les protéines de soie d’araignée grâce à CRISPR, ouvrant la voie à la fonctionnalisation de ces fibres », souligne le Pr Thomas Scheibel dans un communiqué, biologiste des matériaux à Bayreuth. En clair, cette araignée OGM produit une soie “sur mesure”, dotée ici d’un marqueur fluorescent – une première mondiale saluée, détaillée dans la revue Angewandte Chemie.
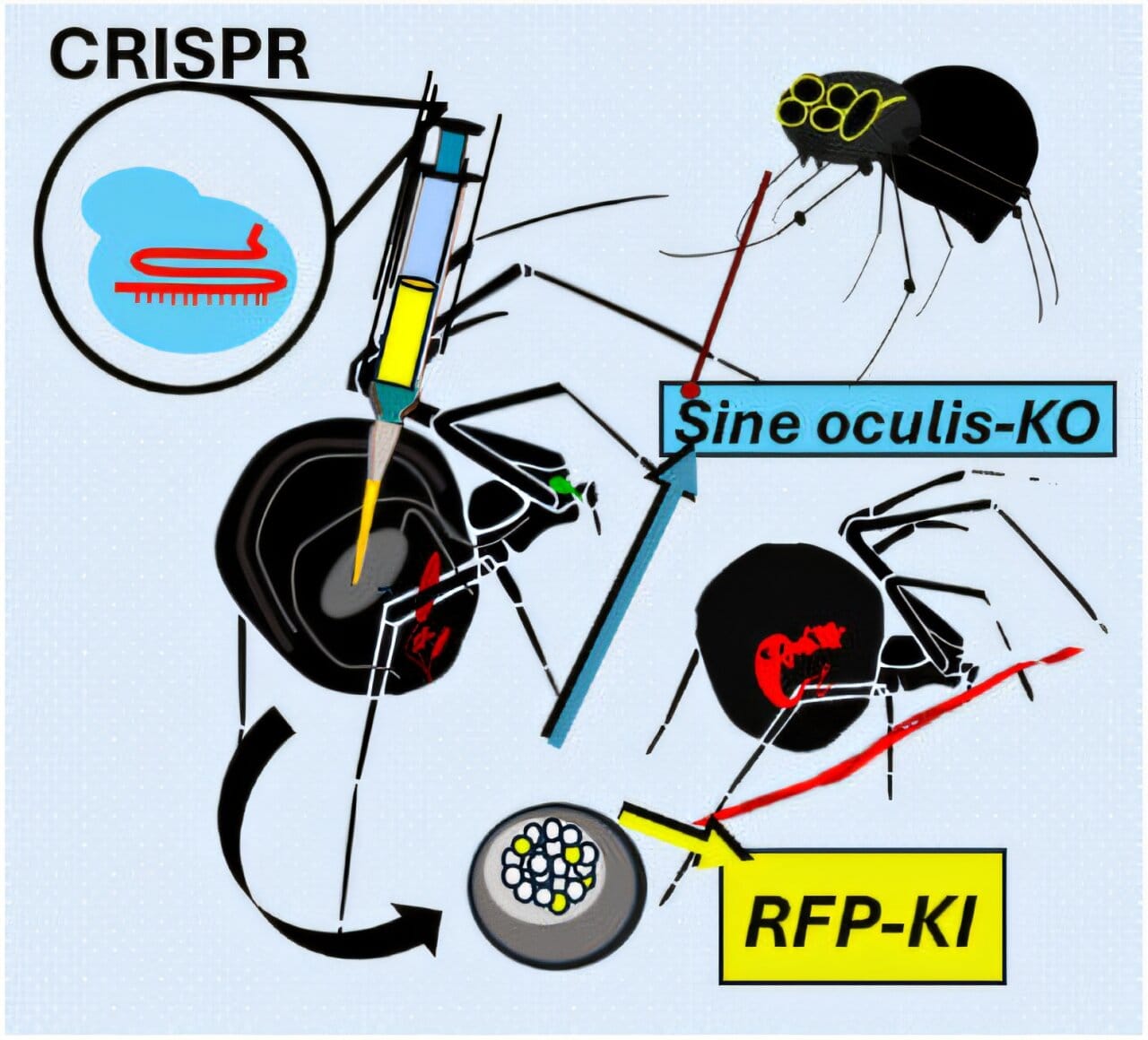
Au-delà du show visuel, l’étude a poursuivi un second objectif scientifique : valider l’outil CRISPR sur l’araignée en désactivant un de ses gènes. Les chercheurs ont ainsi utilisé la technique du knock-out pour neutraliser un gène baptisé sine oculis (signifiant « sans yeux »), soupçonné de contrôler le développement oculaire. Bingo : certaines araignées modifiées sont nées entièrement dépourvues d’yeux, confirmant la fonction clé de ce gène dans la formation des organes visuels. Deux expériences en une, donc, qui démontrent que l’édition du génome chez les araignées est désormais à portée de micropipette.
✊ TLJ n’existe que grâce à vous.
Aucun algorithme. Aucune pub. Juste de l’info libre et essentielle.
❤️ Soutenez-nous avec un abonnement premium.
Innovation réelle ou simple filature des travaux existants ?
Sur le plan technique, parvenir à éditer le génome d’une araignée est un exploit en soi – étonnamment, personne ne l’avait fait avant. « Vu l’éventail d’applications possibles, il est surprenant que CRISPR n’ait jamais été utilisé chez les araignées », note le Pr Scheibel.
Les arachnides posent en effet un casse-tête aux généticiens : génome touffu, embryons délicats à manipuler (les œufs nécessitent une micro-injection très fine et une synchronisation avec l’accouplement), sans oublier que beaucoup d’espèces sont territoriales et cannibales, rendant leur élevage collectif quasi impossible. Le tour de force de Bayreuth a donc été de surmonter ces obstacles avec une solution CRISPR innovante injectée dans des œufs non fécondés, puis de réussir à obtenir des bébés viables porteurs de la modification.
Le fait que le fil de soie soit fluorescent prouve que le gène inséré s’exprime correctement sans perturber l’assemblage naturel du fil. C’est une avancée méthodologique importante : cela signifie qu’on peut désormais envisager de modifier directement la soie chez l’animal, plutôt que d’altérer la fibre après coup en laboratoire. Jusqu’à présent, obtenir des soies “augmentées” nécessitait souvent des traitements post-production coûteux et difficiles à industrialiser.
Toutefois, sur le fond, cette soie d’araignée rouge fluo s’inscrit dans un récit scientifique entamé il y a des décennies. La soie d’araignée fascine depuis longtemps par sa résistance et son élasticité hors normes – plus solide que l’acier à poids égal, et capable de s’allonger sans casser. Mais pour en exploiter des quantités significatives, il a fallu ruser : les araignées ne se prêtant pas à l’élevage intensif (elles s’entretuent en cage, littéralement), des scientifiques ont cherché à la produire via d’autres organismes.
Dès la fin des années 1990, la société Nexia Biotech au Canada avait créé des « chèvres-araignées » en insérant un gène de soie d’araignée dans des chèvres laitières. Leurs glandes mammaires se mirent à sécréter de la protéine de soie (baptisée BioSteel) qu’on pouvait ensuite filer en fibres. L’objectif affiché à l’époque ? Des matériaux ultra-résistants pour des ligaments artificiels, des sutures oculaires… et des gilets pare-balles en soie haute performance.
En parallèle, d’autres équipes se sont tournées vers l’insecte roi du textile : le ver à soie (Bombyx mori). En 2000, des Japonais ont mis au point les premiers vers à soie transgéniques capables d’intégrer des gènes étrangers via un vecteur PiggyBac. Quelques années plus tard, on obtenait des cocons fluorescents en incorporant des gènes de méduses ou de coraux produisant des protéines vertes, rouges ou oranges fluorescentes : dès 2013, Iizuka et al. présentaient des vers à soie GM dont les cocons brillaient en trois couleurs sous UV. Mieux, ces fils fluo étaient presque aussi solides que la soie classique, et ils ont même servi à tisser des tissus du quotidien – costumes, cravates – ainsi qu’une véritable robe de mariée luminescente conçue par la styliste Yumi Katsura. En somme, la soie fluorescente n’est pas nouvelle : on la maîtrisait déjà il y a plus de 10 ans (quoique produite par des chenilles, pas des araignées).
Par ailleurs, la quête de la soie d’araignée haute performance a elle aussi franchi des étapes clés grâce aux vers à soie. En 2012, une équipe américaine réussissait à faire filer à des chenilles OGM une fibre hybride contenant des protéines d’araignée, aboutissant à des fils aussi durs que la dragline naturelle de l’araignée. En 2015, la société américaine Kraig Biocraft a optimisé ces “vers-araignées” avec des techniques modernes (y compris CRISPR) pour créer sa fibre “Dragon Silk” : celle-ci atteint une résistance à la traction de 1,79 GPa, rivalisant avec les aciers de haute tenue mécanique. L’armée américaine teste d’ailleurs ce matériau pour de futurs gilets pare-balles plus légers et flexibles.
En clair, bien avant cette araignée CRISPR, des chèvres et surtout des vers à soie transgéniques avaient déjà ouvert la voie des “super-soies”. La nouveauté, ici, c’est d’avoir appliqué la modification au producteur original, l’araignée elle-même – ce qui est un accomplissement technique remarquable, sans être complètement déconnecté des travaux antérieurs.
✊ TLJ n’existe que grâce à vous.
Aucun algorithme. Aucune pub. Juste de l’info libre et essentielle.
❤️ Soutenez-nous avec un abonnement premium.
Prouesse technique vs. limites biologiques : la réalité du terrain
Si l’araignée de Bayreuth réalise un sans-faute en laboratoire, qu’en est-il des contraintes et des limites ? D’abord, il faut souligner la faible efficacité du processus : les chercheurs ont dû injecter un grand nombre d’œufs et faire s’accoupler de nombreuses femelles pour que seulement 7 % des pontes donnent des araignées modifiées. Chaque cocon de P. tepidariorum contenant environ 250 œufs, cela représente tout de même quelques dizaines d’araignées GM au final, mais le rendement reste très bas – ce qui est courant pour ce genre d’espèce à large portée, notent les auteurs.
Ensuite, la cannibalisation : comme beaucoup d’araignées, ces bébés avaient tendance à se dévorer entre eux si on les laissait ensemble. Les éleveurs ont donc dû isoler individuellement les petites voraces pour qu’elles atteignent l’âge adulte, une logistique lourde… qui confirme exactement la raison pour laquelle on avait renoncé à la ferme d’araignées au profit des chèvres et des vers. « Les tentatives d’élevage intensif d’araignées ont toutes échoué, car mises ensemble, elles tournent vite à l’in-fighting cannibale », rappelle non sans humour un article de 2019 faisant intervenir le Dr Randy Lewis, pionnier des chèvres-araignées.
In fine, produire de la soie en quantité via des araignées reste peu viable. Même boostées aux ciseaux génétiques, nos sympathiques arachnides conservent leurs instincts de prédatrices solitaires. Et ce n’est pas tout : il faudrait aussi parvenir à bobiner et filer leurs mètres de soie ultra-fine (10× plus fine que du fil de ver à soie) d’une manière exploitable, un défi très technique en soi.
Les vers à soie domestiques, dociles depuis 6 000 ans, sont de bien meilleurs candidats pour le travail en grand volume. En effet, si ça ne marche pas avec les araignées, on pourra toujours se tourner vers des vers à soie édités par CRISPR, qui se laissent élever en masse et ne se mangent pas entre eux. Le message est clair : cette percée araignée-CRISPR est un triomphe pour la science fondamentale, mais pas une recette magique pour lancer demain une usine de soie d'araignées mutantes.
Vers des fibres sur mesure : applications et viabilité industrielle
Alors, cette soie rouge fluorescente, révolutionnaire ou gadget ? Pour la recherche, c’est une démonstration puissante. Elle prouve qu’on peut doter la soie d’araignée de fonctions nouvelles en intervenant directement à la source, au sein de la glande séricigène de l’animal.
Aujourd’hui c’est un marqueur fluo, demain ce pourrait être un peptide pour augmenter l’adhérence, une enzyme piégée dans le fil pour lui conférer des propriétés catalytiques, ou des acides aminés modifiés pour créer des fibres conductrices d’électricité. Justement, l’équipe de Bayreuth envisage déjà d’autres super-soies : ils testent des modifications CRISPR visant à rendre la soie hygro-réactive (qui se contracte avec l’humidité) ou capable de changer de couleur en présence de toxines. On entrevoit des applications en ingénierie environnementale (des toiles détectrices de polluants, pourquoi pas). L’intérêt de la soie, c’est qu’elle sert de plate-forme naturelle à ces ajouts : on peut y greffer des fonctions tout en conservant ses atouts intrinsèques que sont la solidité, la flexibilité et la biocompatibilité.
Sur le plan industriel et commercial, le tableau est plus nuancé – non par manque d’applications, mais par défis de production. Les débouchés potentiels pour des fibres inspirées de la soie d’araignée sont pléthoriques. Dans le secteur médical, on rêve de fils de suture biodégradables aussi robustes que l’acier mais résorbables sans cicatrice, de ligaments artificiels souples et quasi incassables, ou de matrices pour la régénération osseuse et cartilagineuse (on expérimente déjà l’impression 3D de supports en soie pour faire repousser de l’os). La soie est inerte et bien tolérée par le corps, pouvant même servir de microcapsule pour délivrer des médicaments de façon contrôlée.
✊ TLJ n’existe que grâce à vous.
Aucun algorithme. Aucune pub. Juste de l’info libre et essentielle.
❤️ Soutenez-nous avec un abonnement premium.
En optique et électronique flexible, on pourrait imaginer des fibres de soie dopées pour servir de capteurs intégrés à des vêtements intelligents ou de fils conducteurs biodégradables. L’intérêt est aussi écologique : à performances égales, la soie l’emporte haut la main sur des matériaux comme le Kevlar ou la fibre de carbone en termes d’énergie de fabrication et d’impact environnemental. Les araignées et vers fabriquent leurs fibres à température ambiante, à partir de protéines renouvelables et sans solvants toxiques, là où le Kevlar exige des procédés industriels à haute température, des acides concentrés et du pétrole, pour un produit non biodégradable.
On comprend pourquoi l’Office of Naval Research des États-Unis finance ces recherches : un fil d’araignée synthétique pourrait à terme offrir des gilets pare-balles aussi résistants que le Kevlar mais nettement plus légers et plus durables. De fait, certaines soies naturelles surpassent déjà le Kevlar en résistance spécifique et absorbent mieux l’énergie (moins de traumatisme sous impact).
L’aérospatiale n’est pas en reste : Airbus teste des panneaux en composite de soie pour alléger ses avions, et la NASA s’intéresse aux boucliers anti-radiations en soie pour les habitats spatiaux. Autant dire que la soie transgénique fait saliver bien du monde – du chirurgien au fabricant d’armes en passant par l’écolo et l’ingénieur aéronautique.
La question n’est donc pas « à quoi bon » mais plutôt « comment produire assez de cette soie miracle ? ». Sur ce front, la stratégie la plus prometteuse consiste à laisser les araignées au labo et confier la production à des organismes plus coopératifs. C’est ici que l’araignée CRISPR rejoint les travaux sur les vers à soie et autres bio-usines : une fois qu’on a identifié une modification génétique intéressante chez l’araignée, rien n’empêche de la transférer dans un ver à soie ou un micro-organisme pour bénéficier d’une production à grande échelle. Par exemple, on pourrait prendre le gène de soie fluorescente rouge testé à Bayreuth et l’introduire dans la chenille de Bombyx – obtenant ainsi des cocons rouges fluorescents en quantité industrielle (le ver, lui, se reproduit sans cannibalisme et fabrique 500 à 800 m de fil par cocon). Idem pour un gène renforçant la solidité : on valide l’édition chez l’araignée in vivo, puis on l’exporte chez le ver pour faire des kilomètres de fibre.
Cette approche est d’autant plus logique que les vers à soie transgéniques existent déjà et que CRISPR permet désormais d’aller plus vite et plus précisément pour les modifier. D’ailleurs, plusieurs start-ups se sont engouffrées dans la brèche de la soie recombinante : la firme allemande AMSilk produit de la soie d’araignée avec des bactéries et l’incorpore dans des textiles biodégradables. Elle a même collaboré avec Adidas pour prototyper des chaussures de running ultralégères en soie (Futurecraft Biofabric). Aux États-Unis, Bolt Threads utilise des levures génétiquement modifiées pour fabriquer son MicroSilk, dont elle a tiré des cravates et une robe haute-couture en partenariat avec Stella McCartney. Et Spintex, une spin-off britannique, a développé un procédé de filage biomimétique 1 000 fois plus efficace énergétiquement que la production de fibres plastiques, promettant une révolution verte dans la mode.
En somme, la soie d’araignée « sur mesure » est en route vers l’industrialisation, mais pas nécessairement via des araignées. Celles-ci joueront plutôt le rôle de R&D : on y teste des gènes, on décrypte les secrets de la toile, puis on confie la production de masse à des hôtes plus commodes (vers, bactéries, levures, voire plantes – certains imaginent même des champs de luzerne OGM sécrétant de la soie !).
Enjeux éthiques et écologiques : la toile se déchire-t-elle ?
Créer des araignées OGM fluorescentes soulève-t-il des questions d’éthique ou d’écologie ? Comparé à d’autres sujets de bioéthique (bébés CRISPR, chimères homme-animal, etc.), le cas de pauvres arachnides modifiées pourrait paraître anecdotique. Néanmoins, l’affaire n’est pas dénuée d’intérêt. Sur le plan du bien-être animal, les araignées ne sont pas protégées par les mêmes régulations que les vertébrés en laboratoire – leur modification ne scandalise pas autant que celle d’un mignon mammifère. Le grand public pourrait même éprouver plus de fascination que d’indignation (après tout, une araignée dont la toile brille rouge, c’est presque poétique… ou effrayant, selon votre sensibilité aux huit pattes).
Il y a toutefois eu des précédents de controverse publique : au Canada, les chèvres transgéniques de Nexia Biotech, exposées un temps dans un musée, ont été retirées face aux protestations du public en 2013. La répugnance instinctive envers l’idée de mélanger les espèces ou de manipuler le vivant peut resurgir, même si les buts sont médicaux ou environnementaux. Il faudra donc accompagner ces innovations d’un effort de communication transparent, sans survendre miracles et merveilles (au risque de décevoir ou de braquer l’opinion).
Côté écologie et biosécurité, on peut se demander ce qui arriverait si une araignée CRISPR s’échappait dans la nature et se reproduisait. Dans le cas présent, la modification (une soie rouge fluorescente) ne confère a priori aucun avantage adaptatif à l’araignée – au contraire, on pourrait spéculer que des toiles brillantes seraient moins efficaces pour la chasse, car plus visibles par les insectes. La lignée modifiée aurait donc peu de chances d’envahir nos greniers en supplantant les araignées normales. Par précaution, les chercheurs maintiennent de toute façon ces animaux en confinement strict. L’expérience vise des applications matérielles, pas à relâcher dans la nature une armée d’araignées mutantes dignes d’un film de Marvel.
Enfin, il y a la question de la finalité militaire. Ce projet a été en partie financé par l’US Navy et l’US Air Force, qui voient dans les soies artificielles des matériaux stratégiques (par exemple, de futurs filets sous-marins ultra-résistants pour neutraliser des hélices de navires). Faut-il s’inquiéter de voir l’araignée devenir une arme ? Probablement pas directement : on parle ici de protection et de défense, pas de développer des araignées géantes qui attaquent l’ennemi. Néanmoins, l’implication de l’armée souligne l’importance géopolitique que pourraient prendre ces super-fibres dans le futur (pensons à l’impact qu’ont eu le Kevlar ou les composites dans l’armement). Comme toujours, la technologie est duale : la soie du futur pourra aussi bien sauver des vies (médecine, écologie) qu’en protéger d’autres de façon moins belliqueuse (armures, dispositifs de sécurité).
Un fil rouge entre hype et espoir
En définitive, il est évident que l’araignée génétiquement modifiée de Bayreuth marque un jalon symboliquement fort et scientifiquement élégant. Elle ouvre la porte à une nouvelle génération de matériaux bio-inspirés aux propriétés programmées. Est-ce la révolution annoncée ? Oui… et non.
Oui, parce que la boîte à outils CRISPR s’étend désormais à un nouvel organisme jusqu’alors inaccessible, promettant des avancées en biomatériaux et en biologie développementale (on comprend mieux les araignées en manipulant leurs gènes).
✊ TLJ n’existe que grâce à vous.
Aucun algorithme. Aucune pub. Juste de l’info libre et essentielle.
❤️ Soutenez-nous avec un abonnement premium.
Non, parce que la route est encore longue pour traduire cette prouesse en applications industrielles concrètes : les promesses de la soie d’araignée “super-matériau” ne datent pas d’hier, et chaque progrès s’est heurté à la dure réalité de la production de masse.
Comme le soulignait le Dr Lewis, « pour la quantité, les vers à soie l’emporteront toujours », tandis que la soie d’araignée servira plutôt à des produits de niche à haute valeur ajoutée dans un premier temps. La soie rouge fluorescente de notre araignée mutante est sans doute destinée aux livres d’histoire de la science plus qu’à nos dressings – à moins qu’une mode ne lance la tendance des vêtements glow in the dark biofabriqués. Quoi qu’il en soit, il ne faut ni minimiser l’importance de cette avancée ni la survendre. Disons que c’est un fil d’Ariane de plus dans la quête du biomatériau de demain : un fil rouge (fluo) qui relie les efforts passés aux innovations à venir.
Reste à voir si ce fil guidera l’industrie hors du labyrinthe technique vers une vraie révolution matérielle, ou s’il finira simplement encadré dans les labos comme curiosité scientifique. En attendant, la science de la soie synthétique continue de tisser sa toile.
L'étude : Angewandte Chemie




